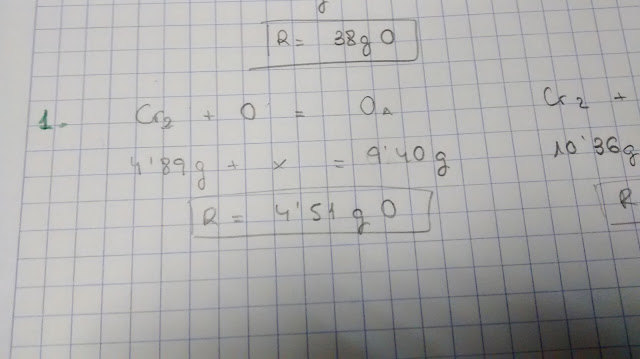En la classe del 15-9 hi havia que fer 3 exercicis treballant per parelles i no es podia preguntar al professor fins que 6 alumnes tenien el mateix dubte (les parelles es podien comunicar entre elles). He anat tirant fotos del que anaven fent els alumnes i ara les comente.
Sobre l'exercici 2 de les fitxes hi ha tres fotos. L'enunciat de l'exercici és:
Quan
es crema el gas butà en presència d'oxigen, es produeix diòxid de
carboni i aigua. Experimentalment podem comprovar que quan cremem 29
g de butà es desprenen 22 g de diòxid de carboni i 45 g d'aigua.
Indica la quantitat d'oxigen que ha reaccionat i la llei en què
bases la resposta.
En classe havia explicat la llei de les proporcions de la conservació de la massa i la de les proporcions definides. Abans de fer l'exercici hi ha que pensar un poc. Estava clar que hi havia que aplicar una de les dos lleis, però hi ha sempre que entendre bé l'enunciat que en aquest cas parla de que hi ha una reacció química i falta la massa d'un dels components. Per tant hi ha que aplicar la llei de la conservació de la massa. Si parlara de que tenim dos elements que formen un compost hi hauria que aplicar la llei de les proporcions definides.
En la primera foto una alumna prova amb l'expressió de la llei de les proporcions definides i clarament no arriba a res. És millor estar més temps analitzant l'enunciat i no començar a escriure ràpidament.
En la segona fota una altra alumna sap fer l'exercici, però no el sap expressar matemàticament perquè està pensant en la llei de les proporcions definides. És molt important saber expressar la física i la química. A més, un altre detall molt important és que en física i química no es pot donar el resultat sense unitats.
En aquesta tercera foto s'intenta fer l'exercici per estequiometria, però per què complicar-se la vida si es pot fer d'una manera més simple? Pensar abans de començar a fer un exercici és la millor manera de que siga més simple.
Ací està l'exercici ben fet. Hi ha que destacar la importància de fer un bon esquema del que diu l'enunciat.
Un altre dels exercicis que hi havia que fer era:
S'oxiden
4,89 g de crom i s'obtenen 9,40 g d'un òxid A. En un altre
experiment, s'oxiden 10,36 g de crom i s'obtenen 15,14 g d'un segon
òxid B.Calcula
la massa d'oxigen que reacciona en cada experiment. Indica la Llei
en que et bases per calcular-la.
D'aquest exercici només he posat una foto i és per comentar que pot ser perillós utilitzar una notació pròpia perquè es pot acabar pensant que l'oxigen és monoatòmic, quan l'oxigen que apareix en l'atmosfera és diatòmic.
Com quedar-se amb tot és molt difícil recorda que hi ha que llegir l'enunciat abans de fer l'exercici tantes vegades com necessites per a que quede clar i després fer un esquema amb les dades de l'enunciat. Recorda donar els resultats amb les unitats corresponents.