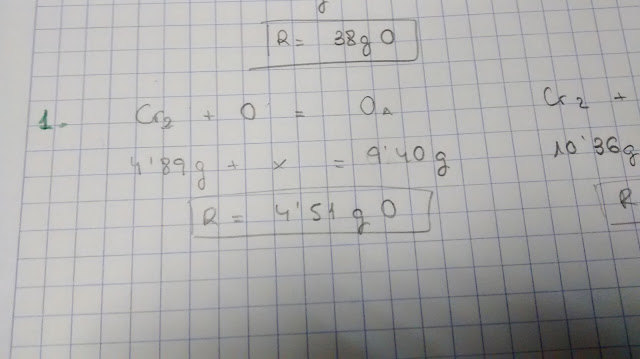dilluns, 28 de setembre del 2015
Exercicis sobre mescla de gasos
Ací tens cinc exercicis fets sobre mescla. Abans de mirar com es fa l'exercici intenta resoldre-ho sense ajuda. Si simplement mires els vídeos sense fer els exercicis pots pensar que ho domines, però si no ho practiques no ho sabràs.
Etiquetes de comentaris:
Gas,
Mescla de gasos,
Objectiu 2 química,
Química
Mescla de gasos
Quan en un determinat volum hi ha més d'un gas tenim una mescla de gasos. Si els gasos són ideals l'equació dels gasos ideals es pot aplicar a cada gas o al conjunt de la mescla de gasos. La pressió total de la mescla de gasos és igual a la suma de la pressió parcial que cada gas exerceix contra les parets del recipient. Açò és fàcil d'entendre si es pensa en termes de la teoria cinètica, ja que la pressió és una mesura del xoc de les partícules que formen el gas contra les parets del recipient. Tot el referent a la mescla de gasos ho tens en el vídeo següent:
Etiquetes de comentaris:
Gas,
Mescla de gasos,
Objectiu 2 química,
Química
divendres, 25 de setembre del 2015
Sobre el mol i conceptes relacionats
En cursos anteriors a 1r de batxillerat s'insisteix molt en el concepte de mol. Si no ho tens clar pots veure aquesta llista de reproducció sobre el mol i conceptes relacionats.
Si recordes més o menys el concepte de mol i només vols saber com es fa un exercici per passar de mol a massa o a molècules igual només necessites veure aquest vídeo:
Si recordes més o menys el concepte de mol i només vols saber com es fa un exercici per passar de mol a massa o a molècules igual només necessites veure aquest vídeo:
Exercicis sobre la llei dels gasos ideals
Ací
tens quatre exercicis fets sobre la llei dels gasos ideals. Seria
ideal que a partir de l'enunciat els intentares resoldre i després
comproves si els has fet bé o no. Si simplement mires els vídeos
sense fer els exercicis pots pensar que ho domines, però si no ho
practiques no ho sabràs.
Etiquetes de comentaris:
Gas,
Llei dels gasos ideals,
Objectiu 2 química,
Química
dijous, 24 de setembre del 2015
Transformació de la llei dels gasos ideals
La
llei dels gasos ideals es pot modificar per introduir la massa molar
i també la densitat. No has d'aprendre de memòria l'equació amb la
massa molar o la densitat. És millor que aprengues a modificar-la
com apareix aquest vídeo i no dependràs de la memòria.
Etiquetes de comentaris:
Gas,
Llei dels gasos ideals,
Objectiu 2 química,
Química
Llei dels gasos ideals
Les
molècules d'un gas es mouen lliurement en línia recta i es desvien
quan xoquen entre elles o amb les parets del recipient. Quan aquestos
xocs els podem considerar elàstics (sense pèrdua d'energia) es pot
aplicar l'equació dels gasos ideals, però has de tindre present que
aquesta equació no es podrà aplicar sempre. Funciona molt bé a
altes temperatures i pressions baixes. Aquest curs si podràs aplicar
sempre aquesta equació que ens indica com es relacionen la pressió
que exerceix un gas sobre les parts del recipient, el volum del
recipient i la temperatura. El vídeo següent explica més sobre
aquesta equació.
Etiquetes de comentaris:
Gas,
Llei dels gasos ideals,
Objectiu 2 química,
Química
dimarts, 22 de setembre del 2015
Idees bàsiques sobre els gasos
En
aquest punt igual és bon recordar un poc en un vídeo les idees
bàsiques que has de saber sobre els gasos.
Etiquetes de comentaris:
Gas,
Objectiu 2 química,
Química
Lleis dels gasos
Hi
ha tres magnituds fonamentals que hi ha que estudiar en els gasos: la
pressió que exerceixen sobre les parets del recipient que els conté,
la seua temperatura i el volum que ocupen. Fixant cadascuna
d'aquestes magnituds i fent experiments per veure com varien les
altres dos entre elles apareixen tres lleis.
Llei
de Boyle-Mariotte.
Ens
indica com varien la pressió i el volum quan es fixa la temperatura.
Llei
de Charles i Gay-Lussac.
Ens
indica com varien el volum i la temperatura quan la pressió és
constant.
Llei
de Gay-Lussac.
Ens
indica com varien la pressió i la temperatura quan el volum és
constant.
Etiquetes de comentaris:
Gas,
Objectiu 2 química,
Química
Objectiu 2 de química
L'objectiu és el següent:
Aplicar l’equació d’estat
dels gasos ideals per a determinar les magnituds que definixen
l’estat d’un gas, per a relacionar les pressions totals i
parcials en una mescla amb les fraccions molars dels components i per
a calcular les fórmules empíriques i moleculars de compostos a
partir de la seua composició centesimal, raonant la utilitat i
limitacions de la hipòtesi de gas ideal.
Què implica aquest
objectiu?-
- Has de conéixer les lleis dels gasos: la llei de Gay-Lussac, la llei de Boyle-Mariotte i la llei de Charles i Gay-Lussac.
- Has de conéixer la llei dels gasos ideals i saber-la transformar per a que aparega la massa molar o la densitat.
- Has de conéixer les limitacions de la hipòtesi del gas ideal.
- Has d'entendre el que passa en una mescla de gasos, les equacions que són aplicables i com es relacionen les pressions parcials amb la fracció molar de cada component.
- Has de calcular les fórmules empíriques i moleculars de compostos a partir de la seua composició centesimal.
dilluns, 21 de setembre del 2015
Hipòtesi d'Avogadro
Dalton
no va saber explicar que les molècules dels elements que apareixen
en la natura en estat gasós, excepte els gasos nobles són
diatòmiques. Si ho va explicar el químic italià Amadeo Avogadro a
partir dels seus treballs experimentals. Per conéixer la hipòtesi
d'Avogadro mira el vídeo següent:
Etiquetes de comentaris:
Gas,
Lleis volumètriques,
Objectiu 2 química,
Química
Exàmens de cursos anteriors
Segurament la millor manera de preparar un examen és fer exàmens dels cursos anteriors. En la carpeta enllaçada teniu molts dels exàmens proposats als alumnes de 1r de batxillerat en cursos anterior. Els del curs 2014-15 estan solucionats, els altres no, però molts exercicis són dels fulls que es van fent en classe o molt pareguts.
Els exàmens del curs 2015-16 també estaran penjats en la mateixa carpeta.
Els exàmens del curs 2015-16 també estaran penjats en la mateixa carpeta.
Etiquetes de comentaris:
Exàmens curs 2015-16,
Exàmens cursos anteriors,
Física,
Química
diumenge, 20 de setembre del 2015
Teoria atòmica de Dalton
Amb
la teoria atòmica de Dalton la idea d'àtom juga un paper central en
la ciència. Encara que et parega que la idea d'àtom sempre va ser
acceptada per tots no sempre va ser així i és des de l'establiment
de la química com a ciència quan ho és.
La
teoria atòmica de Dalton va ser substituïda per altres models que
explicaven millor com és l'àtom, però és molt important perquè
explicava les lleis ponderals. Es basa en aquestes i les explica. En
el vídeo següent pots veure tots els detalls que has de conéixer
sobre aquesta Llei.
Etiquetes de comentaris:
Model atòmic de Dalton,
Objectiu 1 química,
Química
dijous, 17 de setembre del 2015
La Llei de les proporcions múltiples
Introducció.
Aquesta llei la va predir Dalton en la seua teoria atòmica i la va enunciar ell mateix en 1804. És una de les lleis ponderals, açò és, que fa referència a les masses dels elements i que van ser fonamentals en el desenvolupament de la química.
Enunciat.
Les diferents masses d’un mateix element, que es combinen amb una mateixa massa d’un altre element per formar diferents compostos, es troben entre si en una proporció de nombres enters senzills.
Explicació.
L’oxigen i l’hidrogen formen dos compostos: aigua i aigua oxigenada. En l’aigua amb 1 g d’hidrogen es combinen 8 g d’oxigen. En l’aigua oxigenada amb 1 g d’hidrogen es combinen 16 g d’oxigen. Com tenim 1 g d’hidrogen en els dos casos poden veure que la relació entre les masses de O és 8/16=1/2, o siga, que és una relació de nombres enters senzills. Això no ens pot parèixer massa important ara, però quan es va formular aquesta llei no es coneixia quants àtoms de cada element hi havia en l’aigua i l’aigua oxigenada. Aquesta llei va ajudar, juntament amb altres, a establir les fórmules químiques. Ara ens pot semblar evident aquesta relació de ½ per a les masses d’oxigen si sabem que la fórmula química de l’aigua és H2O i la de l’aigua oxigenada és H2O2.
Etiquetes de comentaris:
Lleis ponderals,
Objectiu 1 química,
Química
Vídeos amb exercicis de lleis ponderals
En les últimes entrades d'aquest bloc has vist alguns vídeos on hi ha exercicis sobre lleis ponderals. Ací tens dos vídeos més amb exercicis sobre lleis ponderals.
Etiquetes de comentaris:
Lleis ponderals,
Objectiu 1 química,
Química,
Reactiu limitant
Llei de les proporcions múltiples
La
tercera Llei ponderal i última que vas a estudiar aquest curs,
anomenada Llei de les proporcions múltiples, va ser enunciada
després de la teoria atòmica de Dalton. Ací tens el que diu la
llei.
Algunes
vegades es tendeix a confondre el que diuen la llei de les
proporcions definides i la llei de les proporcions múltiples. Per a
que no les confongues mira el que diu aquest vídeo.
Etiquetes de comentaris:
Lleis ponderals,
Objectiu 1 química,
Química
Alguns detalls sobre els exercicis de les lleis ponderals
En la classe del 15-9 hi havia que fer 3 exercicis treballant per parelles i no es podia preguntar al professor fins que 6 alumnes tenien el mateix dubte (les parelles es podien comunicar entre elles). He anat tirant fotos del que anaven fent els alumnes i ara les comente.
Sobre l'exercici 2 de les fitxes hi ha tres fotos. L'enunciat de l'exercici és:
Quan
es crema el gas butà en presència d'oxigen, es produeix diòxid de
carboni i aigua. Experimentalment podem comprovar que quan cremem 29
g de butà es desprenen 22 g de diòxid de carboni i 45 g d'aigua.
Indica la quantitat d'oxigen que ha reaccionat i la llei en què
bases la resposta.
En classe havia explicat la llei de les proporcions de la conservació de la massa i la de les proporcions definides. Abans de fer l'exercici hi ha que pensar un poc. Estava clar que hi havia que aplicar una de les dos lleis, però hi ha sempre que entendre bé l'enunciat que en aquest cas parla de que hi ha una reacció química i falta la massa d'un dels components. Per tant hi ha que aplicar la llei de la conservació de la massa. Si parlara de que tenim dos elements que formen un compost hi hauria que aplicar la llei de les proporcions definides.
En la primera foto una alumna prova amb l'expressió de la llei de les proporcions definides i clarament no arriba a res. És millor estar més temps analitzant l'enunciat i no començar a escriure ràpidament.
En la segona fota una altra alumna sap fer l'exercici, però no el sap expressar matemàticament perquè està pensant en la llei de les proporcions definides. És molt important saber expressar la física i la química. A més, un altre detall molt important és que en física i química no es pot donar el resultat sense unitats.
En aquesta tercera foto s'intenta fer l'exercici per estequiometria, però per què complicar-se la vida si es pot fer d'una manera més simple? Pensar abans de començar a fer un exercici és la millor manera de que siga més simple.
Ací està l'exercici ben fet. Hi ha que destacar la importància de fer un bon esquema del que diu l'enunciat.
Un altre dels exercicis que hi havia que fer era:
S'oxiden
4,89 g de crom i s'obtenen 9,40 g d'un òxid A. En un altre
experiment, s'oxiden 10,36 g de crom i s'obtenen 15,14 g d'un segon
òxid B.Calcula
la massa d'oxigen que reacciona en cada experiment. Indica la Llei
en que et bases per calcular-la.
D'aquest exercici només he posat una foto i és per comentar que pot ser perillós utilitzar una notació pròpia perquè es pot acabar pensant que l'oxigen és monoatòmic, quan l'oxigen que apareix en l'atmosfera és diatòmic.
Com quedar-se amb tot és molt difícil recorda que hi ha que llegir l'enunciat abans de fer l'exercici tantes vegades com necessites per a que quede clar i després fer un esquema amb les dades de l'enunciat. Recorda donar els resultats amb les unitats corresponents.
Etiquetes de comentaris:
Lleis ponderals,
Objectiu 1 química,
Química
dilluns, 14 de setembre del 2015
Relació entre la Llei de les proporcions definides i el reactiu limitant
Sempre
que dos substàncies es posen en contacte i reaccionen químicament
no té perquè reaccionar les quantitats completes de les dos
substàncies que tenim. De fet, si tenim dos substàncies que
reacciones quan s'acaba una de les substàncies l'altra ja no pot
reaccionar. La substància que s'acaba primer és el reactiu limitant
i hi ha un excés de l'altra. Per entendre millor açò mira el
següent vídeo:
Etiquetes de comentaris:
Lleis ponderals,
Objectiu 1 química,
Química,
Reactiu limitant
Lleis ponderals 1: Llei de la conservació de la massa i Llei de les proporcions definides.
La
primera llei ponderal és la llei de la conservació de la massa, que
diu que en una reacció química la massa dels reactius és igual a
la massa dels productes.
La
segona llei ponderal és la llei de les proporcions múltiples que
diu que quan dos elements es combinen per a formar un compost la
relació entre les masses dels elements és sempre la mateixa
independentment de com s'ha format el compost.
Etiquetes de comentaris:
Lleis ponderals,
Objectiu 1 química,
Química
dissabte, 12 de setembre del 2015
Lleis ponderals i volumètriques
El
final del segle XVIII va ser una època molt productiva per a la
química, ja que va ser l'època en que aquesta disciplina va abraçar
el mètode científic i va deixar de ser simplement empírica a
tindre un important cos teòric darrere. Tot açò va culminar amb la
teoria atòmica de Dalton, però per establir aquesta teoria dos
importants lleis van ser formulades: la llei de la conservació de la
massa i la Llei de les proporcions definides. Aquestes Lleis,
juntament amb altres com la Llei de les proporciones múltiples,
s'anomenen Lleis ponderals perquè fan referència a la massa de les
substàncies. A banda d'aquestes llei també hi ha unes altres Lleis
que van servir per establir la química tal com la coneixem hui en
dia: són les lleis volumètriques, que estan referides als volums
dels gasos que intervenen en una reacció química. En aquest vídeo
explica perquè són importants les lleis ponderals i les
volumètriques.
Per
entendre la importància d'aquestes Lleis adopta la mentalitat que
tenien els químics d'aquella època. No sabien amb tota certesa
quines substàncies eren elements i quins compostos, no sabien les
fórmules dels compostos. De fet, va ser el seu treball qui va
començar a definir la química tal com la coneixem hui en dia.
Encara
que les lleis volumètriques són importants es veuran més endavant
i ara toca centrar-se en les ponderals.
Etiquetes de comentaris:
Gas,
Lleis ponderals,
Lleis volumètriques,
Objectiu 1 química,
Química
divendres, 11 de setembre del 2015
Objectiu 1 de química
L'objectiu és el
següent:
Utilitzar les lleis
fonamentals de la Química per a justificar la teoria atòmica de
Dalton i la discontinuïtat de la matèria, exemplificant-ho amb
reaccions.
Què implica aquest
objectiu?
- Has de saber que són les lleis ponderals i volumètriques i perquè són importants.
- Has de conéixer perfectament les següents lleis ponderals: llei de la conservació de la massa, llei de les proporcions definides, lleis de les proporcions múltiples.
- Has de fer xicotets exercicis matemàtics relacionats amb les lleis ponderals.
- Has de conéixer el model atòmic de Dalton. Els seus postulats, les seues limitacions i com aquest model explica les lleis ponderals. Has de tindre clar com les lleis ponderals fonamenten el fet de que la matèria siga discontínua.
- A partir de dibuixar xicotets esquemes de reaccions químiques has de saber interpretar les lleis ponderals.
Criteris qualificació
El primer de tot en
qualsevol tipus de curs que afrontes és que conegues com s'obté la qualificació final del curs, de cada trimestre i com es pot recuperar. Si penses que els criteris no són justos proposa
modificacions la primera setmana de curs, que es quan es poden
canviar. Ací tens l'enllaç als criteris.
Presentació
Aquest és el bloc d'aula de la classe de física i química de 1r de batxillerat de l'IES Llombai. És un bloc destinat per a alumnes de 1r de batxillerat de l'IES Llombai, encara que és benvingut qualsevol que arribe ací i espere que siga útil per a tots.
El pas de l'ESO a batxillerat mai és fàcil. És el pas d'un ensenyament obligatori a un ensenyament postobligatori. El batxillerat és un període molt curt, intens, on s'ha de progressar en la manera en que s'estudia, en que es decideix que es va a estudiar després, en que massa vegades hi ha massa pressió per la nota per entrar en determinats estudis. Si estàs llegint açò i eres de primer de batxillerat pensa que serà molt més important l'actitud que tingues en cada moment de la vida que la nota que obtingues en batxillerat. Centra't en treballar cada dia i en millorar com a estudiant.
Respecte a l'assignatura de física i química és important destacar que els conceptes són durs i no s'aprenen instantàniament. Necessiten temps i treball per a dominar-los. Amb quatre hores de classe a la setmana és molt difícil aconseguir-ho i fa falta un poc més. En aquest sentit espere que aquest bloc siga un mecanisme d'ajuda que done informació i al mateix temps permeta interaccionar amb el professor i altres companys. Per participar només s'ha d'utilitzar l'identificador de google i preguntar o comentar sobre les diferents entrades.
Sigues el que siguen en la vida no tingues por a equivocar-te. Sàpigues que tots ens equivoquem. Com a professor m'equivoque i no passa res. Com a persones tenim dret a equivocar-nos i és més, l'error és una poderosa eina per a progressar. Així que si en aquest bloc, en els vídeos que he fet o en els solucionaris dels exercicis que pose a la teua disposició trobes algun error o no acabes de veure clara alguna cosa interacciona.
En aquest bloc no ho trobaràs tot, però si trobaràs molt de la física i química de 1r de batxillerat. Ja saps, no tingues por a equivocar-te i interacciona.
El pas de l'ESO a batxillerat mai és fàcil. És el pas d'un ensenyament obligatori a un ensenyament postobligatori. El batxillerat és un període molt curt, intens, on s'ha de progressar en la manera en que s'estudia, en que es decideix que es va a estudiar després, en que massa vegades hi ha massa pressió per la nota per entrar en determinats estudis. Si estàs llegint açò i eres de primer de batxillerat pensa que serà molt més important l'actitud que tingues en cada moment de la vida que la nota que obtingues en batxillerat. Centra't en treballar cada dia i en millorar com a estudiant.
Respecte a l'assignatura de física i química és important destacar que els conceptes són durs i no s'aprenen instantàniament. Necessiten temps i treball per a dominar-los. Amb quatre hores de classe a la setmana és molt difícil aconseguir-ho i fa falta un poc més. En aquest sentit espere que aquest bloc siga un mecanisme d'ajuda que done informació i al mateix temps permeta interaccionar amb el professor i altres companys. Per participar només s'ha d'utilitzar l'identificador de google i preguntar o comentar sobre les diferents entrades.
Sigues el que siguen en la vida no tingues por a equivocar-te. Sàpigues que tots ens equivoquem. Com a professor m'equivoque i no passa res. Com a persones tenim dret a equivocar-nos i és més, l'error és una poderosa eina per a progressar. Així que si en aquest bloc, en els vídeos que he fet o en els solucionaris dels exercicis que pose a la teua disposició trobes algun error o no acabes de veure clara alguna cosa interacciona.
En aquest bloc no ho trobaràs tot, però si trobaràs molt de la física i química de 1r de batxillerat. Ja saps, no tingues por a equivocar-te i interacciona.
Subscriure's a:
Missatges (Atom)