Diu
el següent:
Si
una sèrie de reactius reaccionen per a donar una sèrie de
productes, la calor de reacció alliberat o absorbida és independent
de si la reacció es duu a terme en una, dues o més etapes.
Això
implica que si matemàticament l'equació química que representa una
reacció es pot posar com la suma o resta d'altres equacions
químiques (encara que estiguen multiplicades per un número)
aleshores la variació de l'entalpia de la reacció es pot calcular
com la suma o resta de les entalpies de cada cada reacció de la
mateixa manera en que combinant les equacions químiques s'obté la
primera.
Com
a conseqüència d'aquesta llei si d'una reacció química es té
l'entalpia de formació de cada compost que apareix en una reacció,
la variació d'entalpia d'una reacció es pot calcula a partir de la
següent expressió:
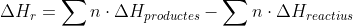
que
diu que la variació d'entalpia de la reacció es calcula sumant el
producte del nombre de mol de cada producte per la seua entalpia de
la reacció i restant a la suma del nombre de mol de cada reactiu
del nombre de mol de cada producte per la seua entalpia de la
reacció.