A
partir de l'entalpia i l'entropia es defineix una nova magnitud
anomenada energia lliure de
Gibbs G de la següent manera:
G=H-T·S
La unitat de l'energia lliure
de Gibbs en el sistema internacional és el Joule (J).
Si la temperatura i la pressió
es constant es pot escriure:
Si:
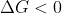 :una reacció química és espontània.
:una reacció química és espontània.
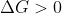
:
una reacció química no és espontània.
És interessant analitzar els
dos termes de la resta a la que és igual l'energia lliure de Gibbs.
 representa l'energia total transferida en el procés.
representa l'energia total transferida en el procés.
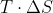 representa la part d'energia
que no és aprofitable per fer un treball. Per tant, és l'energia
que no es pot aprofitar.
representa la part d'energia
que no és aprofitable per fer un treball. Per tant, és l'energia
que no es pot aprofitar.
A
partir de l'expressió de
l'energia lliure de Gibbs es pot veure que sí:
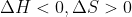 : la reacció sempre és
espontània.
: la reacció sempre és
espontània.
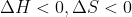 : la reacció és espontània a
baixes temperatures (quan el terme de la variació l'entalpia és
major en valor absolut al producte de la temperatura per la variació d'entropia).
: la reacció és espontània a
baixes temperatures (quan el terme de la variació l'entalpia és
major en valor absolut al producte de la temperatura per la variació d'entropia).
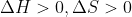 : la reacció és espontània a
altes temperatures. (quan el terme de la variació l'entalpia és menor en valor absolut al producte de la temperatura per la variació d'entropia).
: la reacció és espontània a
altes temperatures. (quan el terme de la variació l'entalpia és menor en valor absolut al producte de la temperatura per la variació d'entropia).
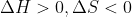
:
la reacció mai és espontània.
Cap comentari:
Publica un comentari a l'entrada